GBR 引導骨再生手術 – 人工植牙治療
Guided Bone Regeneration – Membrane Technique
作者:陳映瑜醫師 鄭聖達醫師
摘要
本篇文章為簡介引導骨再生技術中membrane technique的部分。其原理基於導引再生技術的研究,並隨著植牙的發展而在臨床上扮演重要的角色。主要的概念在於使用barrier membrane篩選偏好的細胞進入骨缺損區生長,以恢復骨脊體積利於後續的咬合重建或達到美觀。因此依照骨缺損的大小還有類型(垂直、水平、或結合兩者的缺損),barrier membrane和bone substitutes的選擇上便可能會有所不同。當骨缺損越大時,通常傾向選擇吸收速度慢和較為rigid的barrier membrane,以及吸收速度較慢的bone substitutes。雖然並沒有研究可以指出何種材料具有顯著優於他者的效果,但不同的材料均有研究得到良好的補骨成果,故手術醫師可以考量病人的骨缺損型態後,依自己個人熟悉度、操作上的偏好、以及材料特性去進行選擇。後續內文整理一些常見的barrier membrane和bone substitutes分屬的類型提供給醫師們參考。
一 原理
再生牙周治療技術改變了手術的思維,提供了可預期的結果。導引組織再生技術(Guided Tissue Regeneration, GTR)早先見於80年代Nyman1,2等人使用barrier membrane的研究,而導引骨再生技術(Guided Bone Regeneration, GBR)的研究,便是基於GTR在特定區域選擇性促使細胞生長的概念,近二十年來隨著植牙發展,GBR在臨床角色也更加重要。不同於GTR需要骨、牙周韌帶、牙骨質的再生才算達成牙周再生,GBR著重在骨生成的促成,其目標在於透過放置屏蔽(barrier)分離周邊軟組織,阻止生長速度較快的纖維母細胞進入骨缺損區域生長,和促進周邊骨生成細胞移入骨缺損區,使垂直、頰舌側、或合併兩方向的骨缺失可恢復所需的體積。
二 GBR的原則
如果能夠確實依照原則執行,GBR是一項相當有預測性和一致性的術式。Wang3於2006年提出PASS作為預測成功骨再生的準則:
- Primary wound closure(初級傷口縫合):無張力的初級縫合,確保傷口癒合不被干擾。一旦membrane暴露,可造成membrane過早吸收,無法隔絕表皮細胞生長,甚至是發生感染,則新骨生長的量會有相當程度的減少(Machtei4, 2001)。
- Angiogenesis(血管生成):提供必要的氧氣和養分和未分化間葉細胞,通常血液的供應來自於原有的網路,所以術後應該盡量保存原有血液供應來源至股生成所需的區域 (Greenstein5, 2009; Schwarz6, 2008)。
- Space maintenance(空間維持):創造適當的空間提供骨生成,理論上吸收速度慢和較硬的membrane,對於空間維持的效果較好,但也會延長新骨生成完成所需的時間。有時會搭配骨釘或骨螺絲等物來協助membrane,支撐出骨再生所需的空間。
- Stability of wound (傷口性穩定性):穩定血塊生成才有利於後續癒合。微量的移動可能造成membrane細胞排除的效果變差,使得骨細胞被迫和纖維母細胞競爭生長。
三 屏障膜(barrier membrane)
Membrane選擇的考量包含生物相容性、排除特定細胞、空間維持能力、軟組織整合能力、臨床上要易於操作。Dahlin7 1988年在rats上人工製造標準化尺寸的骨缺損實驗,發現使用ePTFE membrane的組別可以完全恢復骨頭,沒使用membrane隔絕軟組織組別的傷口則是被纖維組織入侵。之後Kostopoulos8 1994年則是比較使用可吸收性membrane與沒使用的組別間差異,亦得到有使用membrane時具有較好的骨生成效果的結論。
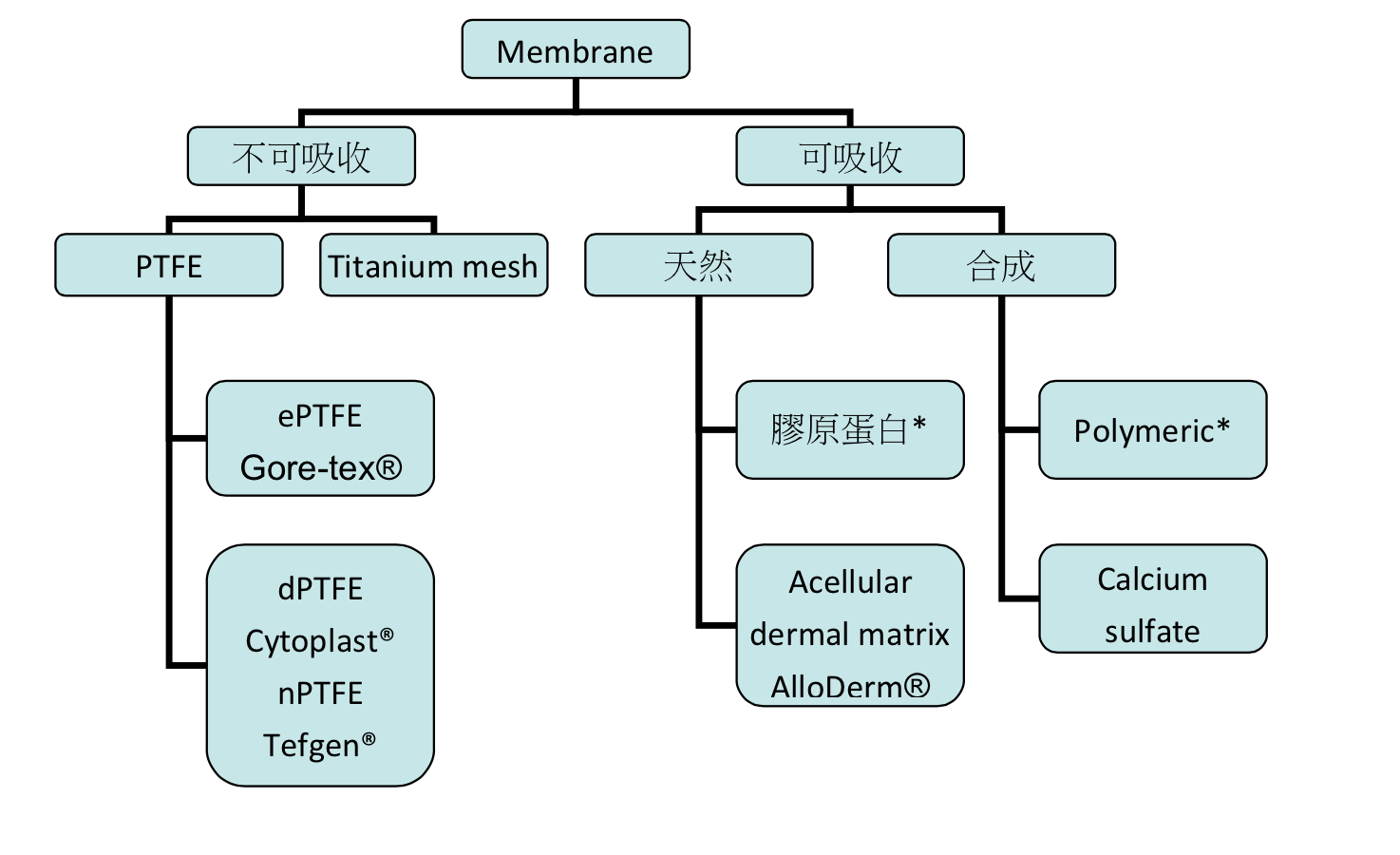
圖1:一些常見membrane與其分類
1 不可吸收membrane
此類型membrane早期大量生產的產品是Teflon(e-PTFE),其包含兩個部分:collar portion和occlusive portion,達到篩選特定組織生長的目的。PTFE(polytetrafluoroethylene)是一種合成的氟化聚合物,Buser9 1990的研究指出使用e-PTFE membrane配合tenting pins在骨增高術可得到1.5mm-5.5mm不等的新生骨。由於在membrane下提供空間對於骨增高是項重要的條件,因此Titanium-reinforced membranes被研發出來。
因ePTFE表面較粗糙利於細菌的附著,初級傷口縫合更顯重要,一旦發生發炎反應可能影響到治療成果,且曾有研究提出Exposure rate高達31%(Lang NP10, 1994)。另一方面使用不可吸收membrane需要第二次手術移除,是其一缺點,但能提供space-making效果。
由於ePTFE的一些缺點,dPTFE應運而生(Bartee BK11, 1995)。dPTFE的孔洞小於3µm,可用於難以達到初級傷口縫合的情境之下,可以不需要releasing incision提高翻瓣的自由度,不會改變mucogingival junction位置,也就有更好的美觀結果。另一方面因為dPTFE membrane較為平滑,移除也較為方便,其表面特性也使其較不易發生感染(Hoffmann12, 2008)。
2 可吸收membrane
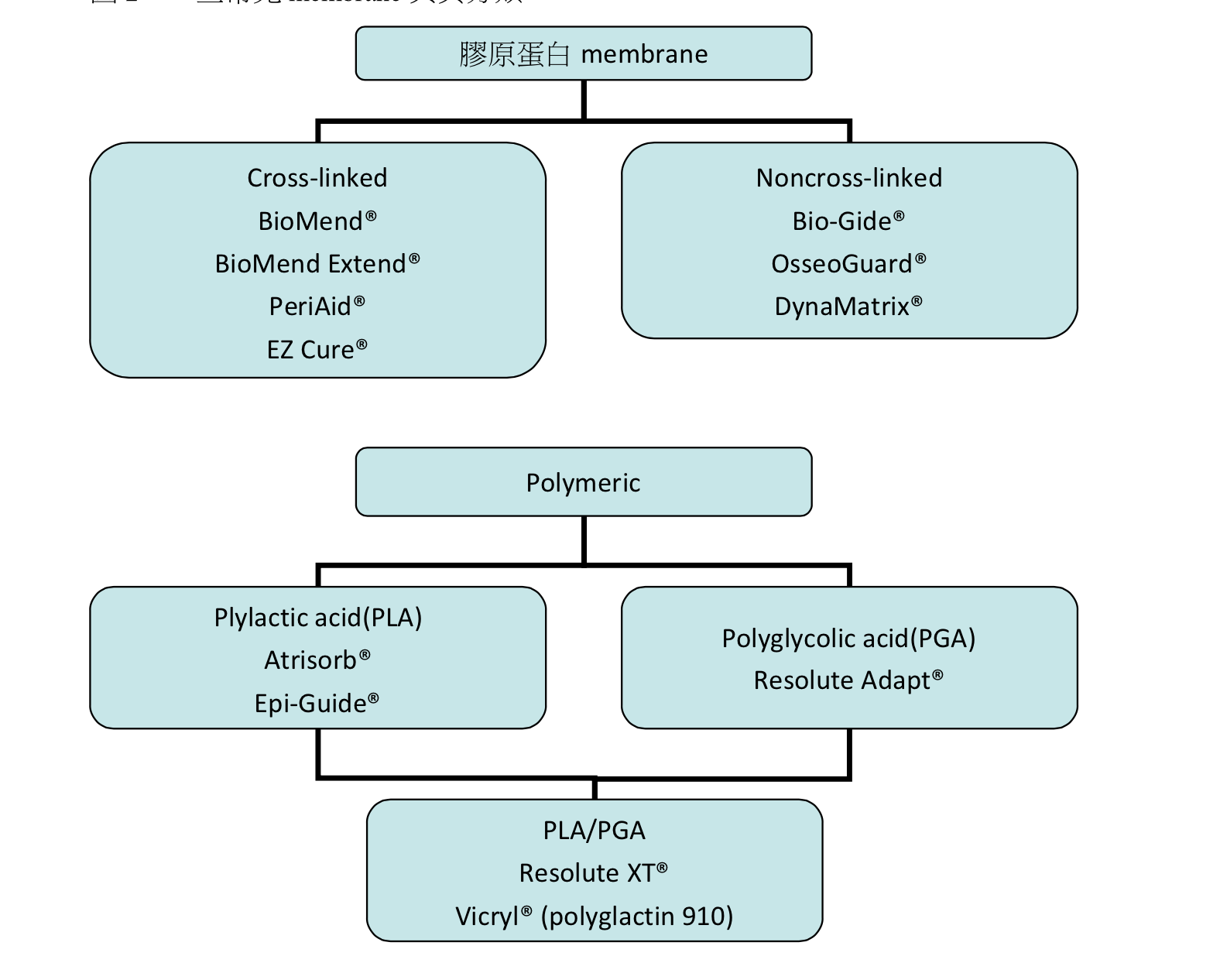
圖2:一些常見membrane與其分類
表1 一些常見membrane的參考吸收時間
| Membrane | 參考吸收時間 |
| BioMend® | 8 weeks |
| BioMend Extend® | 18 weeks |
| PeriAid® | 26~38 weeks |
| EZ Cure® | 12 weeks |
| Bio-Gide® | 24 weeks |
| OsseoGuard® | 24-32 weeks |
| DynaMatrix® | Epithelialization in 8 to 12 weeks |
| Atrisorb® | 36-48 weeks |
| Epi-Guide® | 24-48 weeks |
| Vicryl® (polyglactin 910) | 8 weeks |
生物性可吸收membrane可以分為天然來源和人工合成兩大類,其中以天然來源分類中的膠原蛋白membrane最為常見。良好的膠原蛋白membrane可具有以下的特質:
- Hemostasis(止血):膠原蛋白可刺激血小板附著進而提升fibrin linkage,因此在一開始對血塊形成和穩定有幫助。(Wang HL13, 2001)
- Chemotaxis(趨化):在體外實驗中發現對纖維母細胞有趨化作用,在體內此項特質有利於cell migration。
- Ease of manipulation: 較易於操作。
- Well tolerated:較不容易引發免疫反應。
- Bioresorbable: 因為膠原蛋白在被酵素代謝的過程中是生物上可吸收的,可以參與軟組織癒合,使得手術區組織厚度提升而保護下方的骨生成。
- Slow absorption:membrane應該要保持在原位直到手術區的細胞已建立好再生的能力,較小的缺損也通常需要4至6周才達到穩定。為了延長被吸收的時間,有membrane會加以處理使其分子cross-linked。越高的cross-linked程度有較長的吸收時間,雖然可以保持良好的空間維持效果但也影響組織整合、血液循環,甚至造成異物反應(Rothamel14, 2005)。
3 Membrane的選擇
選擇何種membrane的考量著重於我們需要補骨的程度和骨缺損的形狀。因woven bone生長速度約每天60µm,所以少於5mm的補骨量大約需要4-6個月的等待,而大於5mm的補骨量更是需要6個月甚至一年的等待時間(Berglundh15, 2003; Cardaropoli16, 2003; Chou17, 2007; El Helow and El Askary Ael18, 2008)。骨缺損量越大的時候,membrane的space-making能力還有吸收速度都會是考慮的重點,醫師可以選用自己熟悉操作、吸收速度符合要求且支持效果合宜的membrane。
四 移植骨材
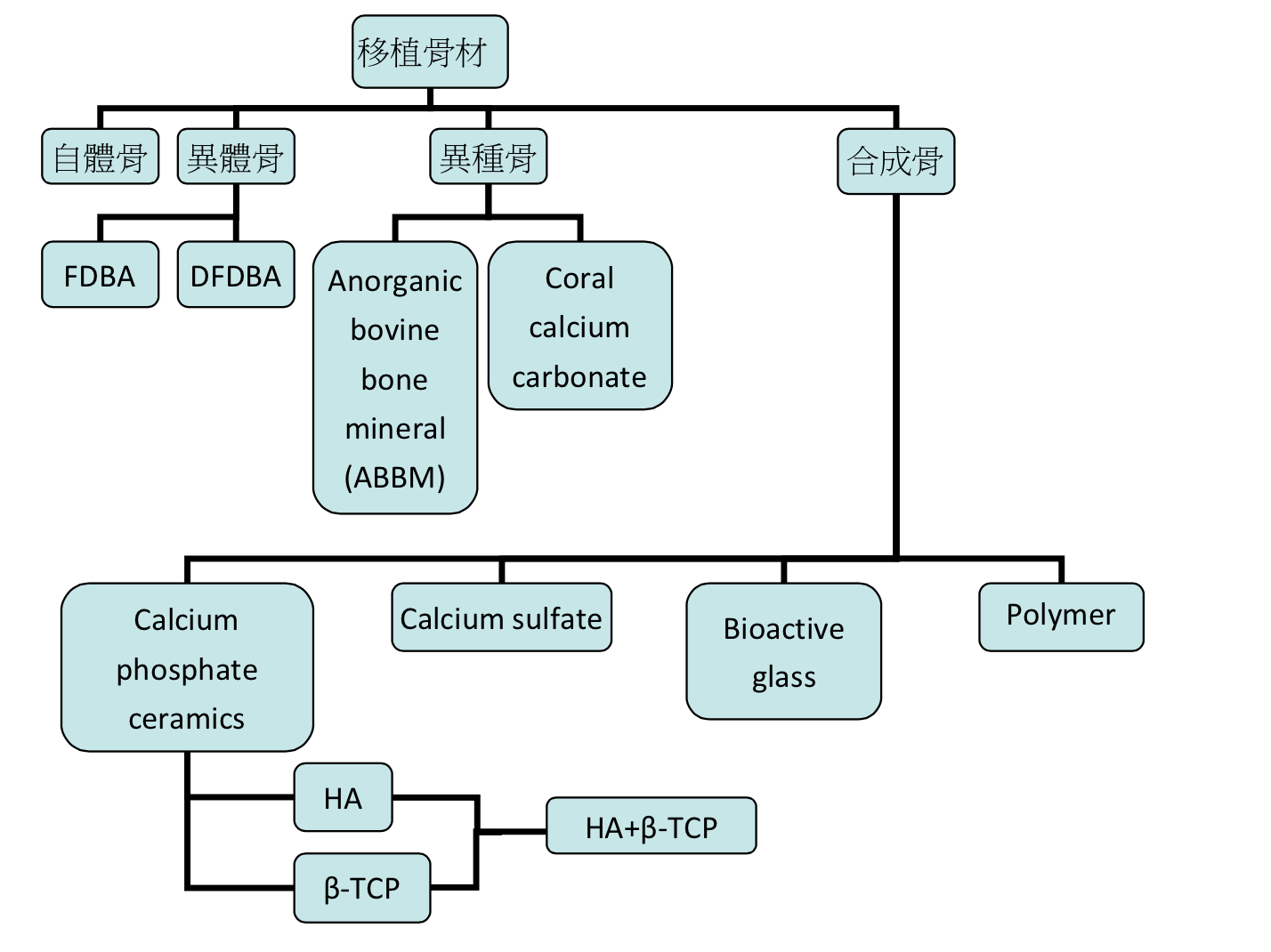
在GBR的術式中,於membrane之下給予物理性支撐或是放置移植骨材等方式,可以維持空間以及避免membrane塌陷。另一方面使用移植骨材也是基於期望可以有osteogenic potential (含有骨生成細胞),osteoinductive (骨誘導的能力), 或是osteoconductive(作為scaffold提供給骨生成)的作用。骨替代物的分類可以依照來源分為自體骨(autograft)、異體骨(allograft)、異種骨(xenograft)和合成骨(alloplasts)。不管上述類別是單獨使用或是搭配使用,均有成功的案例報告(Hollinger19, 1996)。
圖3:一些常見移植骨材與其分類
異體骨: Puros®, Dynagraft®, OraGRAFT®, Grafton® DBM, MinerOss®
異種骨: BioOss® , Endobon®, Osteograf-N®, Sinbone®
合成骨: Bioceramics-HA®, Straumann bone ceramic®, MBCP®, Cerasorb®, Osteograf-D®
1 Autograft
Autogenous bone graft具有osteoinduction的效果,其來源可以分為口內及口外兩種。口內自體骨可以從maxillary tuberosity、拔牙後傷口(8-12周)、tori或exostosis等位置取得。當皮質骨比例較多則骨生成的潛力較差,另一方面cancellous bone擁有較多造血骨髓具有較高生長潛力。
2 Allografts
異體骨取自同種的其他個體上,依照處理方式可以分為冷凍、冷凍乾燥、冷凍乾燥去礦化三種,又依照產品的形式則可以分成顆粒狀、膠狀、泥狀等。使用異體骨的好處是不需要另闢一個手術區域來取補骨材,也不受限於自體骨可取得量上的限制。必須注意使用異體骨一定要選擇處理過程安全無虞的有保障的。
許多研究顯示DFDBA可得到良好骨生成的結果( Hauschka20, 1986; Sampath21, 1987; Urist22, 1984),但另一方面也有研究發現DFDBA的補骨效果較為不可預測,可能會受受捐贈者本身條件影響(Shigeyama23, 1995; Becker24, 1995; Schwartz25, 1996)。
DFDBA吸收時間一般約為3至4個月,適合於小型骨缺損使用,而FDBA吸收時間較長,可用於較大的骨缺損區域。在組織學上比較FDBA和DFDBA用於補骨手術上並沒有顯著的差別(Cammack26, 2005)。
3 Xenografts
異種骨是從他種生物取得,一切有機成分都被移除掉避免引發免疫反應,其餘的無機成分提供architectural matrix的功能還有提供calcium來源,在補骨手術重塑(remodeling phase)過程中可幫助維持體積。
4 Alloplasts
合成骨選擇眾多,不同的化學組成、物理形式、表面性質使他們在生物可吸收能力差異很大,以calcium phosphate–based graft materials為例,從通透性、幾何形狀、溶解度到密度都會影響其吸收速度。Calcium sulfate and calcium phosphate compounds在生物相容性、操作性質、porosity、融解速度、物理化學性質上都和bone mineral相似是其優勢。
5 移植骨材的選擇
移植骨材的選擇上和membrane的考量相似,如果需要補骨的量較大,尤其是缺乏空間維持能力的缺損時,或者是使用可吸收membrane時,會希望移植骨材的吸收速度較慢好維持骨新生所需要的空間。因此面對較大量的骨缺損時,吸收速度較慢的FDBA,或者是一些加工過變得具有可塑型的合成骨材料都是可以考慮的方向。
五 GBR效果
單純GBR補骨成果的研究較少,較常是為了利於植牙而進行補骨。有系統性回顧文獻指出使用ePTFE的成功率從67%到100%不等(Chiapasco27, 2006)。而之後有系統性回顧針對水平補骨術式得到的成功率則為87%到95%(Donos28, 2008)。無法得到預期的補骨效果可能和membrane暴露或是感染有關,也可能是再生骨自然的吸收所造成。整體來說使用membrane technique的方式在較小或是self-contained的缺損還是有相當不錯的效果。針對水平或是垂直方向的缺損可以得到3mm左右的補骨量(Buser29,1990; Chiapasco30, 1999; Proussaefs and Lozada31, 2003; Chiapasco32, 2004; Proussaefs and Lozada33, 2006; Steigmann34, 2006; Geurs35, 2008; Hämmerle36, 2008; Pieri37, 2008; Artzi38, 2003; Feuille39, 2003; Fontana40, 2008),而針對骨開窗或骨開裂的缺損也多可達到超過90%的成功率(Dahlin41, 1995; von Arx and Kurt42, 1999; Wang43, 2004; Blanco44, 2005; De Boever and De Boever45, 2005; Moses46, 2005)。
在新生骨放置植體的存活率也相當不錯。一篇回顧統計各種補骨方式(GBR、onlay/inlay、distraction osteogenesis)植體存活率可達95.5%(Aghaloo and Moy47, 2007),針對GBR術式的統計指出植體分別在水平向補骨和垂直向補骨區域上的存活率為98%和99.3%(Chiapasco27, 2006)。新生骨和原生骨上的植體存活率並沒有明顯的差異(Donos28, 2008; Fiorellini and Nevins48, 2003; Hämmerle49, 2002)。
六 總結
GBR用在水平向、垂直向、植牙同時補骨時的骨開窗、骨開裂都可以有不錯的成效,一般而言在水平方向上補骨會比垂直方向容易達到。3mm補骨量是個粗估可行的預測值,如果面對更大量的缺損則可考慮配合其他的方式,因為GBR術式在具有space-making的缺損時有較高的可預測性。另在新生骨上植牙和原生骨同樣可以得到良好的存活率。
不論是可吸收或不可吸收membrane都有研究指出可以得到良好的結果,並沒有研究指出某種membrane優於其他種類,但面對較大的缺損時membrane越需要能夠保持其完整性和撐出形狀,這是選擇membrane種類時的一大考量。不論是使用可吸收或不可吸收membrane搭配使用移植骨材均有其好處,如果選用的membrane不是很硬挺的情況下移植骨材的使用就更顯重要。目前來說各種類型的移植骨材不論是單獨使用或是配合使用都有研究支持可以得到良好的植體存活率。
操作GBR術式時的決定性因素還包含了醫師的技術與經驗(Hämmerle and Jung50, 2003),選擇材料的考量除了針對骨缺損型態還有操作性和熟悉性,謹慎的術前規劃和臨床檢查是成功不可或缺的步驟。
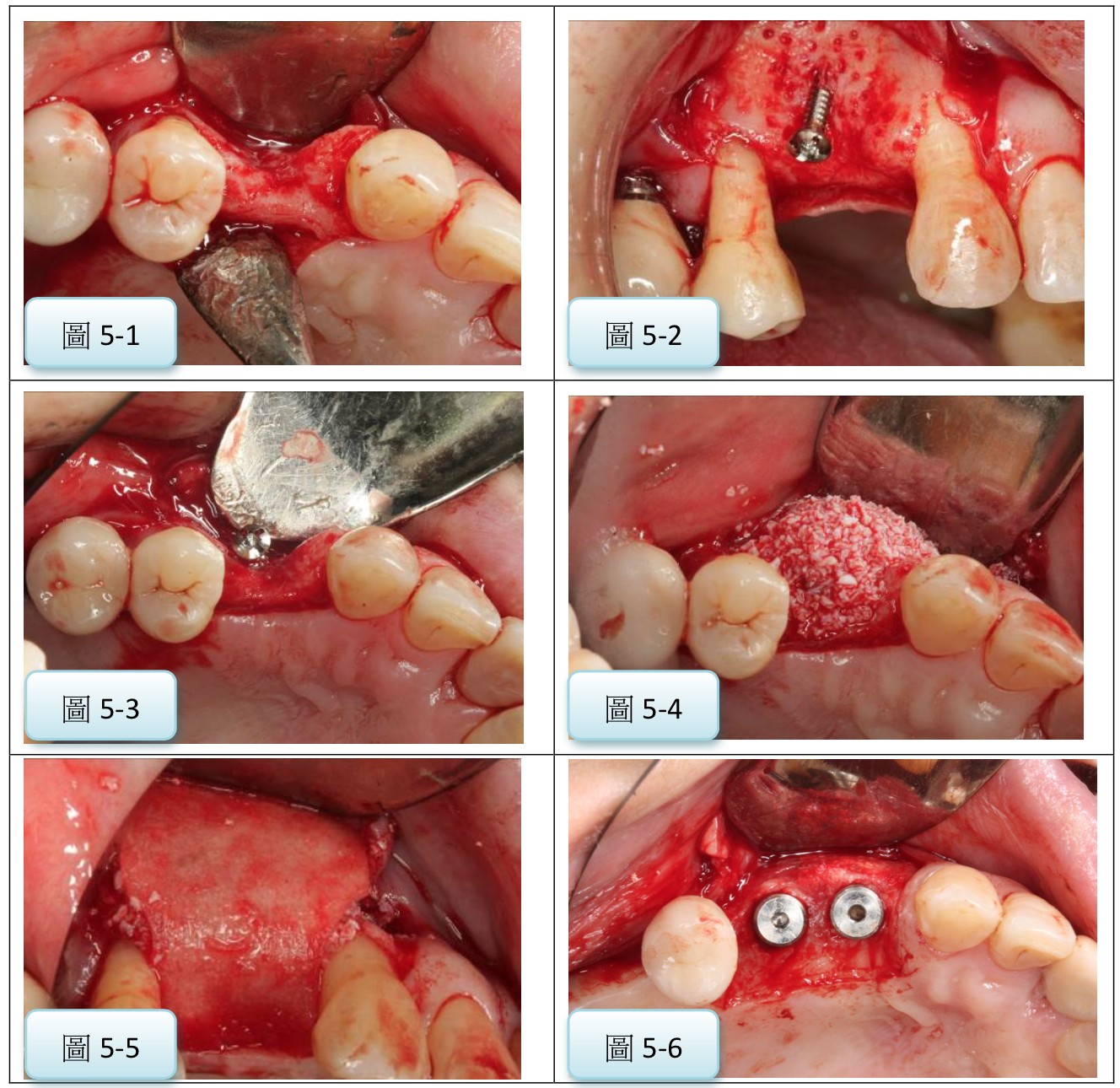
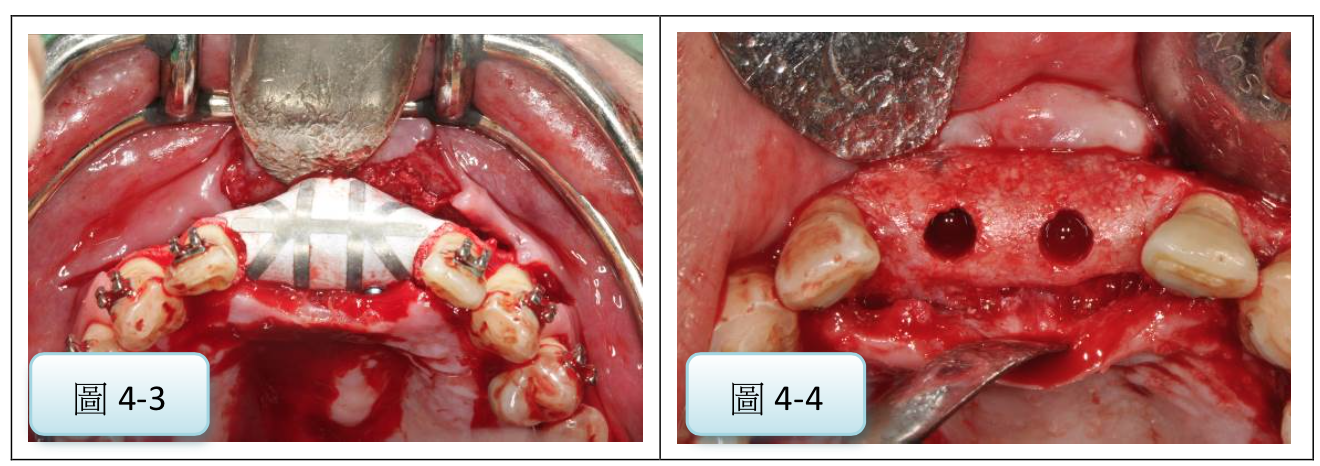
圖4:使用不可吸收膜進行GBR術式補骨後,可種植入合適直徑的植體(案例提供:鄭聖達醫師)
圖5:使用可吸收膜配合tenting screw進行GBR術式後,順利可放入植體(案例提供:鄭聖達醫師)
七 參考文獻
1 Karring T, Nyman S, Lindhe J. Healing following implantation of periodontitis affected roots into bone tissue. J Clin Periodontol. 1980 Apr;7(2):96-105.
2 Nyman S. Bone regeneration using the principle of guided tissue regeneration. J Clin Periodontol. 1991 Jul;18(6):494-8.
3 Wang HL, Boyapati L. “PASS” principles for predictable bone regeneration. Implant Dent. 2006 Mar;15(1):8-17.
4 Machtei EE. The effect of membrane exposure on the outcome of regenerative procedures in humans: a meta-analysis. J Periodontol. 2001 Apr;72(4):512-6.
5 Greenstein G, Greenstein B, Cavallaro J, Tarnow D. The role of bone decortication in enhancing the results of guided bone regeneration: a literature review. J Periodontol. 2009 Feb;80(2):175-89.
6 Schwarz F, Rothamel D, Herten M, Wüstefeld M, Sager M, Ferrari D, Becker J. Immunohistochemical characterization of guided bone regeneration at a dehiscence-type defect using different barrier membranes: an experimental study in dogs. Clin Oral Implants Res. 2008 Apr;19(4):402-15.
7 Dahlin C, Linde A, Gottlow J, Nyman S. Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg. 1988 May;81(5):672-6.
8 Kostopoulos L, Karring T. Guided bone regeneration in mandibular defects in rats using a bioresorbable polymer. Clin Oral Implants Res. 1994 Jun;5(2):66-74.
9 Buser D, Bragger U, Lang NP, Nyman S. Regeneration and enlargement of jaw bone using guided tissue regeneration. Clin Oral Implants Res 1990; 1: 22-32.
10 Lang NP, Hämmerle CH, Bragger U, Lehmann B, Nyman SR. Guided tissue regeneration in jawbone defects prior to implant placement. Clin Oral Implants Res 1994; 5: 7-92.
11 Bartee BK, Carr JA. Evaluation of a high-density polytetrafluoroethylene (n-PTFE) membrane as a barrier material to facilitate guided bone regeneration in the rat mandible. J Oral Implantol 1995; 21(2): 88-95.
12 Hoffmann O, Bartee BK, Beaumont C, Kasaj A, Deli G, Zafiropoulos GG. Alveolar bone preservation in extraction sockets using non-resorbable dPTFE membranes: a retrospective non-randomized study. J Periodontol 2008; 79(8): 1355-69.
13 Wang HL, Carroll MJ. Guided bone regeneration using bone grafts and collagen membranes. Quintessence Int 2001;32(7): 504-15.
14 Rothamel D, Schwarz F, Sager M, Herten M, Sculean A, Becker J. Biodegradation of differently cross-linked collagen membranes: an experimental study in the rat. Clin Oral Implants Res 2005; 16: 369-78.
15 Berglundh T, Abrahamsson I, Lang NP, Lindhe J. De novo alveolar bone formation adjacent to endosseous implants. Clin Oral Implants Res. 2003 Jun;14(3):251-62.
16 Cardaropoli G, Araújo M, Lindhe J. Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs. J Clin Periodontol. 2003 Sep;30(9):809-18.
17 Chou AH, LeGeros RZ, Chen Z, Li Y. Antibacterial effect of zinc phosphate mineralized guided bone regeneration membranes. Implant Dent. 2007 Mar;16(1):89-100.
18 El Helow K, El Askary Ael S. Regenerative barriers in immediate implant placement: a literature review. Implant Dent. 2008 Sep;17(3):360-71.
19 Hollinger JO, Brekke J, Gruskin E, Lee D. Role of bone substitutes. Clin Orthop 1996;Mar(324):55-65.
20 Hauschka PV, Mavrakos AE, Iafrati MD, et al. Growth factors in bone matrix. Isolation of multiple types by affinity chromatography on heparin-sepharose. J Biol Chem 1986;261:12665-12674.
21 Sampath TK, Muthukumaran N, Reddi AH. Isolation of osteogenin, an extracellular matrix-associated, bone-inductive protein, by heparin affinity chromatography. Proc Natl Acad Sci USA 1987;84:7109-7113
22 Urist MR, Huo YK, Brownell AG, et al. Purification of bovine bone morphogenetic protein by hydroxyapatite chromatography. Proc Natl Acad Sci USA 1984; 81:371-375
23 Shigeyama Y, D’Errico JA, Stone R, et al. Commercially-prepared allograft material has biological activity in vitro. J Periodontol 1995;66:478-487.
24 Becker W, Urist MR, Tucker LM, et al. Human demineralized freeze-dried bone: Inadequate induced bone formation in athymic mice. A preliminary report. J Periodontol 1995;66:822-828.
25 Schwartz Z, Mellonig JT, Carnes DL Jr., et al. Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation. J Periodontol 1996;67:918-926.
26 Cammack GV II, Nevins M, Clem DS III, et al. Histologic evaluation of mineralized and demineralized freeze-dried bone allograft for ridge and sinus augmentations. Int J Periodontics Restorative Dent 2005; 25:231-237.
27 Chiapasco M, Zaniboni M, Boisco M. Augmentation procedures for the rehabilitation of deficient edentulous ridges with oral implants. Clin Oral Implants Res. 2006 Oct;17 Suppl 2:136-59.
28 Donos N, Mardas N, Chadha V. Clinical outcomes of implants following lateral bone augmentation: systematic assessment of available options (barrier membranes, bone grafts, split osteotomy). J Clin Periodontol. 2008 Sep;35(8 Suppl):173-202.
29 Buser D, Brägger U, Lang NP, Nyman S. Regeneration and enlargement of jaw bone using guided tissue regeneration. Clin Oral Implants Res. 1990 Dec;1(1):22-32.
30 Chiapasco M, Abati S, Romeo E, Vogel G. Clinical outcome of autogenous bone blocks or guided bone regeneration with e-PTFE membranes for the reconstruction of narrow edentulous ridges. Clin Oral Implants Res. 1999 Aug;10(4):278-88.
31 Proussaefs P, Lozada J. The use of resorbable collagen membrane in conjunction with autogenous bone graft and inorganic bovine mineral for buccal/labial alveolar ridge augmentation: a pilot study. J Prosthet Dent. 2003 Dec;90(6):530-8.
32 Chiapasco M, Romeo E, Casentini P, Rimondini L. Alveolar distraction osteogenesis vs. vertical guided bone regeneration for the correction of vertically deficient edentulous ridges: a 1-3-year prospective study on humans. Clin Oral Implants Res. 2004 Feb;15(1):82-95.
33 Proussaefs P, Lozada J. Use of titanium mesh for staged localized alveolar ridge augmentation: clinical and histologic-histomorphometric evaluation. J Oral Implantol. 2006;32(5):237-47.
34 Steigmann M. Pericardium membrane and xenograft particulate grafting materials for horizontal alveolar ridge defects. Implant Dent. 2006 Jun;15(2):186-91.
35 Geurs NC, Korostoff JM, Vassilopoulos PJ, Kang TH, Jeffcoat M, Kellar R, Reddy MS. Clinical and histologic assessment of lateral alveolar ridge augmentation using a synthetic long-term bioabsorbable membrane and an allograft. J Periodontol. 2008 Jul;79(7):1133-40.
36 Hämmerle CH, Jung RE, Yaman D, Lang NP. Ridge augmentation by applying bioresorbable membranes and deproteinized bovine bone mineral: a report of twelve consecutive cases. Clin Oral Implants Res. 2008 Jan;19(1):19-25.
37 Pieri F, Corinaldesi G, Fini M, Aldini NN, Giardino R, Marchetti C. Alveolar ridge augmentation with titanium mesh and a combination of autogenous bone and anorganic bovine bone: a 2-year prospective study. J Periodontol. 2008 Nov;79(11):2093-103.
38 Artzi Z, Dayan D, Alpern Y, Nemcovsky CE. Vertical ridge augmentation using xenogenic material supported by a configured titanium mesh: clinicohistopathologic and histochemical study. Int J Oral Maxillofac Implants. 2003 May-Jun;18(3):440-6.
39 Feuille F, Knapp CI, Brunsvold MA, Mellonig JT. Clinical and histologic evaluation of bone-replacement grafts in the treatment of localized alveolar ridge defects. Part 1: Mineralized freeze-dried bone allograft. Int J Periodontics Restorative Dent. 2003 Feb;23(1):29-35.
40 Fontana F, Santoro F, Maiorana C, Iezzi G, Piattelli A, Simion M. Clinical and histologic evaluation of allogeneic bone matrix versus autogenous bone chips associated with titanium-reinforced e-PTFE membrane for vertical ridge augmentation: a prospective pilot study. Int J Oral Maxillofac Implants. 2008 Nov-Dec;23(6):1003-12.
41 Dahlin C, Lekholm U, Becker W, Becker B, Higuchi K, Callens A, van Steenberghe D. Treatment of fenestration and dehiscence bone defects around oral implants using the guided tissue regeneration technique: a prospective multicenter study. Int J Oral Maxillofac Implants. 1995 May-Jun;10(3):312-8.
42 von Arx T, Kurt B. Implant placement and simultaneous ridge augmentation using autogenous bone and a micro titanium mesh: a prospective clinical study with 20 implants. Clin Oral Implants Res. 1999 Feb;10(1):24-33.
43 Wang HL, Misch C, Neiva RF. “Sandwich” bone augmentation technique: rationale and report of pilot cases. Int J Periodontics Restorative Dent. 2004 Jun;24(3):232-45.
44 Blanco J, Alonso A, Sanz M. Long-term results and survival rate of implants treated with guided bone regeneration: a 5-year case series prospective study. Clin Oral Implants Res. 2005 Jun;16(3):294-301.
45 De Boever AL, De Boever JA. Guided bone regeneration around non-submerged implants in narrow alveolar ridges: a prospective long-term clinical study. Clin Oral Implants Res. 2005 Oct;16(5):549-56.
46 Moses O, Pitaru S, Artzi Z, Nemcovsky CE. Healing of dehiscence-type defects in implants placed together with different barrier membranes: a comparative clinical study. Clin Oral Implants Res. 2005 Apr;16(2):210-9.
47 Aghaloo TL, Moy PK. Which hard tissue augmentation techniques are the most successful in furnishing bony support for implant placement? Int J Oral Maxillofac Implants. 2007;22 Suppl:49-70.
48 Fiorellini JP, Nevins ML. Localized ridge augmentation/preservation. A systematic review. Ann Periodontol. 2003 Dec;8(1):321-7.
49 Hämmerle CH, Jung RE, Feloutzis A. A systematic review of the survival of implants in bone sites augmented with barrier membranes (guided bone regeneration) in partially edentulous patients. J Clin Periodontol. 2002;29 Suppl 3:226-31; discussion 232-3.
50 Hämmerle CH, Jung RE. Bone augmentation by means of barrier membranes. Periodontol 2000. 2003;33:36-53.[/vc_column_text][/vc_column][/vc_row]